En 1909, Soren P. Sörensen (1868-1939) definió el pH de una disolución como el logaritmo negativo de la concentración de iones hidrógeno (H+). Siendo la expresión matemática:
![]()
Así, para las distintas disoluciones se tiene que:
| Disolución Ácida |
| pH < 7 |
| Disolución Neutra |
| pH = 7 |
| Disolución Básica |
| pH > 7 |
Análogamente, se define la expresión de pOH como:
![]()
Escala de pH
El rango de la escala de pH va desde 0 hasta 14 en disolución acuosa. Se trata de una escala logarítmica de base 10, variando en una unidad por cada potencia de 10. Al observar la escala de pH se puede apreciar que al aumentar la concentración de iones hidrógeno, el pH disminuye.
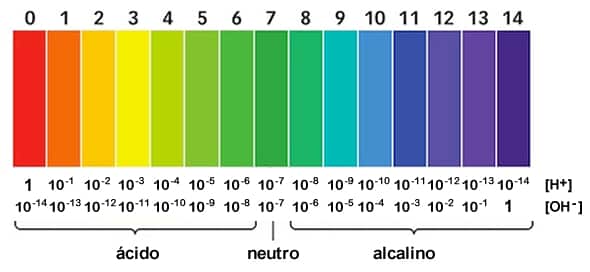
pH : La definición de pH solo se estableció como una manera de simplificar el trabajo con números tan pequeños como eran los valores de las concentraciones de las disoluciones acuosas.
Indicador Acido – Base
Un indicador ácido-base es una sustancia que presenta colores muy diferentes a los medios ácidos y básicos. El pH de una disolución se puede medir a través de:

Repollo morado
- Un pigmento vegetal, como el que contiene el repollo morado o las tiras de papel tornasol, los cuales, en medio ácido, tornan la disolución a color rojo; y En medio básico, a color azul.

pH-metro
- Mediante aparatos llamados pH-metros, basados en métodos electroquímicos, que miden el pH directamente con gran rapidez y exactitud.

Papel pH
- Mediante indicadores que determinan el pH solo en forma aproximada, por ejemplo, el indicador universal o papel pH. En otros casos, son disoluciones diluidas, como la fenolftaleína o el azul de bromotimol.

