En el siglo XVII, Robert Boyle estudió en forma sistemática y cuantitativa el comportamiento de los gases. En una serie de experimentos, Boyle analizó la relación que existe entre la presión y el volumen de una muestra de un gas.
Para una cierta cantidad de un gas a una temperatura constante, el volumen del gas es inversamente proporcional a su presión. A medida que la presión aumenta, el volumen ocupado por el gas disminuye. Por lo contrario, si la presión aplicada disminuye, el volumen ocupado por el gas aumenta. Esta relación se conoce como la Ley de Boyle.
Matemáticamente se puede expresar esta relación inversa entre presión y volumen como :
o
Cuando se reemplaza el símbolo de proporcionalidad, por un signo igual y una constante de proporcionalidad, se ve que el producto de la presión y el volumen de una cantidad fija de gas, a una temperatura dada, es una constante (). El valor de a depende de la cantidad de gas y de la temperatura. La ecuación
, se puede utilizar para deducir otra ecuación útil cuando un gas sufre una transformación a temperatura constante. Si escribimos la ecuación para un estado inicial (i) y otro final (f), se obtiene :
y
Como ambos productos son iguales al mismo valor de
, se obtiene:
La ecuación anterior se usa para relacionar los cambios de presión y volumen.
Para realizar sus experimentos con gases, Boyle utilizó un tubo con forma de J. Una cantidad de gas queda atrapada en el tubo detrás de una columna de mercurio. Boyle cambió la presión a la que estaba sometido el gas agregando mercurio al tubo, y observó que el volumen del gas disminuía al aumentar la presión.
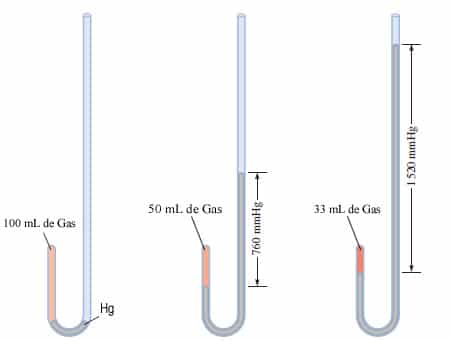
Para realizar sus experimentos con gases, Boyle utilizó un tubo con forma de J
En la primera figura, los niveles del mercurio son iguales y la presión del gas es igual a la presión atmosférica (760 mmHg). El volumen del gas es de 100 mL. Al duplicar la presión mediante la adición de más mercurio, el volumen del gas se reduce a 50 mL. Al triplicar la presión, el volumen del gas disminuye a un tercio del valor original. La temperatura y cantidad del gas se mantienen constantes.


