Los químicos caracterizan los procesos e identifican las sustancias mediante la estimación de ciertas propiedades particulares de estos. Para determinar muchas de esas propiedades es necesario tomar mediciones físicas.
Medir es comparar la magnitud física que se desea cuantificar con una cantidad patrón que se denomina unidad. El resultado de una medición indica el número de veces que la unidad está contenida en la magnitud que se mide.

Medir es comparar una unidad patrón con aquello que se desea cuantificar.
Las mediciones que hacen los químicos frecuentemente se utilizan a menudo en cálculos para obtener otras cantidades relacionadas. Existen diferentes instrumentos que permiten medir las propiedades de una sustancia; con la cinta métrica se miden longitudes, mientras que con la bureta, la pipeta, la probeta graduada y el matraz volumétrico se miden volúmenes. Con la balanza se mide la masa, y con el termómetro la temperatura. Estos instrumentos permiten hacer mediciones de propiedades macroscópicas, es decir, que pueden ser determinadas directamente. Las propiedades microscópicas, a escala atómica molecular se deben determinar por un método indirecto.

Una cantidad medida suele escribirse como un número con una unidad apropiada. Así, decir que la distancia en automóvil entre Nueva York y San Francisco por cierta carretera es “5166” no tiene significado. Se debe especificar que la distancia es de 5166 kilómetros. Lo mismo es válido en la química; las unidades son indispensables para expresar en forma correcta las mediciones.
Las Magnitudes Físicas
No todos los rasgos que caracterizan un cuerpo o un determinado fenómeno pueden ser cuantificados. Por ejemplo, el olor y el sabor no pueden ser estimados objetivamente, sino que dependen de la apreciación de diferentes individuos. Aquellos rasgos que pueden ser medidos se denominan magnitudes físicas. Existen dos tipos de magnitudes físicas:
- Magnitudes fundamentales: son aquellas que no dependen de ninguna otra medida, expresan simplemente el número de veces que está la unidad patrón en lo que se desea medir, como por ejemplo la masa, la temperatura o la longitud.
- Magnitudes derivadas: son aquellas que se expresan como la relación entre dos o más magnitudes fundamentales. Por ejemplo, la densidad indica la cantidad de masa presente en una cierta unidad de volumen.
Unidades del Sistema Internacional
Las primeras mediciones se basaron probablemente en el cuerpo humano, por ejemplo expresando la longitud en pies. Luego, diferentes regiones estandarizaron unidades para su uso exclusivo. Cuando empezó a hacerse común el intercambio de conocimiento entre regiones, hacia mediados del siglo XIX, esta diversidad en la manera de medir se convirtió en un serio inconveniente.
Para solucionar estos problemas la Academia de Ciencias de Francia creo el Sistema Internacional de Unidades (SI), según el cual existen siete magnitudes fundamentales, a partir de las cuales es posible expresar cualquier otra magnitud derivada. Sin embargo, también es empleado el sistema inglés, en donde se utilizan: el pie, la pulgada y la milla como unidades de longitud; la libra, como unidad de masa; el segundo, como unidad de tiempo; el grado Fahrenheit, como unidad de temperatura y el BTU, como unidad de presión.
Durante muchos años los científicos expresaron las mediciones en unidades métricas relacionadas entre sí decimalmente; es decir, en potencias de 10. sin embargo, en 1960, la Conferencia General de Pesas y Medidas, que es la autoridad Internacional del Sistema de Unidades, propuso un sistema métrico revisado y actualizado, al que denomino Sistema Internacional de Unidades (SI), En la tabla inferior se expone las siete unidades básicas y fundamentales del SI.
| Unidades del Sistema Internacional Básicas | ||
|---|---|---|
| Cantidad Fundamental | Nombre de la Unidad | Símbolo |
| Longitud | metro | m |
| Masa | kilogramo | kg |
| Tiempo | segundo | s |
| Corriente Eléctrica | ampere | A |
| Temperatura | kelvin | K |
| Cantidad de Sustancia | mol | mol |
| Intensidad | candela | cd |
También se incluye un sistema de unidades, las cuales cambian en forma decimal por medio de una serie de prefijos, cada prefijo posee un símbolo y refleja en específico una cantidad.
Las mediciones que se utilizan con frecuencia en el estudio de la química son tiempo, masa, volumen, densidad y temperatura.
- Tiempo: La Unidad del Sistema Internacional de Medidas, fundamental para medir Tiempo es el Segundo, ya que es ideal para efectuar estudios químicos.
- Masa: La Unidad del Sistema Internacional de Medidas, fundamental para medir Masa es el Kilogramo (Kg), sin embargo en Química se utiliza el gramo (g), ya que es una unidad más pequeña y a la vez más conveniente en estudios químicos.
- Volumen: La Unidad del Sistema Internacional de Medidas, fundamental para medir Volumen es el Metro Cubico (mt3), sin embargo en química se utiliza el centímetro cubico o el decímetro cubico, ya que es una unidad más pequeña y a la vez más conveniente en estudios químicos.
- Densidad: La Unidad del Sistema Internacional de Medidas, fundamental para medir Densidad es el Kilogramo / Metro Cubico (Kg/mt3).
- Temperatura: La Unidad del Sistema Internacional de Medidas, fundamental para medir Temperatura es Kelvin (K), sin embargo en el estudio de la química se incluyen escalas como Celsius y Fahrenheit.
Equivalencia entre unidades
No siempre utilizamos el SI de unidades. Con frecuencia, y especialmente en química empleamos unidades muy pequeñas, así por ejemplo expresamos la masa en gramos o miligramos (mg), o la longitud en micras (pm) o nanómetros (nm). En estos casos debemos transformar unas unidades en otras equivalentes. La solución de estos inconvenientes está en el empleo de múltiplos y submúltiplos de las respectivas unidades.
En la figura se presenta una tabla que contiene los prefijos más comunes y su respectiva equivalencia.


Para transformar la unidad en que se expresa la medida de una magnitud fundamental en su correspondiente unidad SI, basta conocer los múltiplos y submúltiplos de dicha unidad.
Así, por ejemplo, si queremos transformar 5 metros en centímetros, debemos saber que un metro equivale a 100 centímetros y por lo tanto los 5 metros equivalen a:
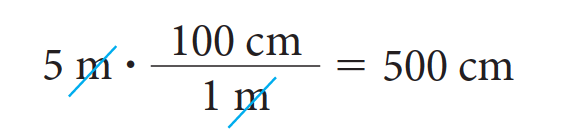
Si el caso corresponde a una magnitud derivada debemos considerar su definición y luego aplicar la transformación a cada una de las magnitudes fundamentales que la definen. Veamos algunos ejemplos.
Ejemplo 1 : Expresar la velocidad de un automóvil cuyo valor es 80 km/h en metros por segundo.
La solución requiere de la siguiente consideración:
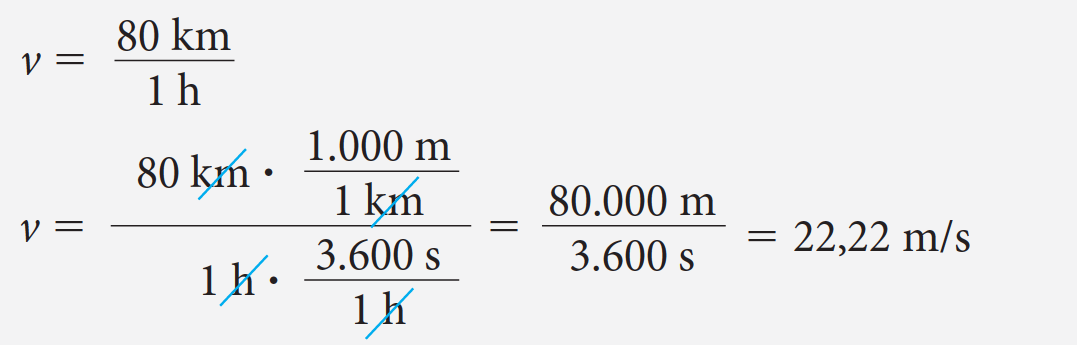
Observemos que en la operación anterior se utiliza la equivalencia de 1 km a 1.000 m y de 1 h a 3.600 s esto permite simplificar, y así, en la respuesta aparecen solo las unidades de equivalencia (m/s).
Ejemplo 2: Calcular el volumen en centímetros cúbicos de una caja de 0,5 metros de largo, 20 cm de ancho y 30 mm de profundidad.
El volumen expresa la capacidad que tiene un cuerpo y se expresa:
- V = largo x ancho x profundidad
Ahora hay que convertir los 0,5 m a cm y los 30 mm a cm.

Entonces, aplicando la fórmula de volumen tenemos
V = 50 cm X 3 cm X 20 cm = 3.000 cm3

